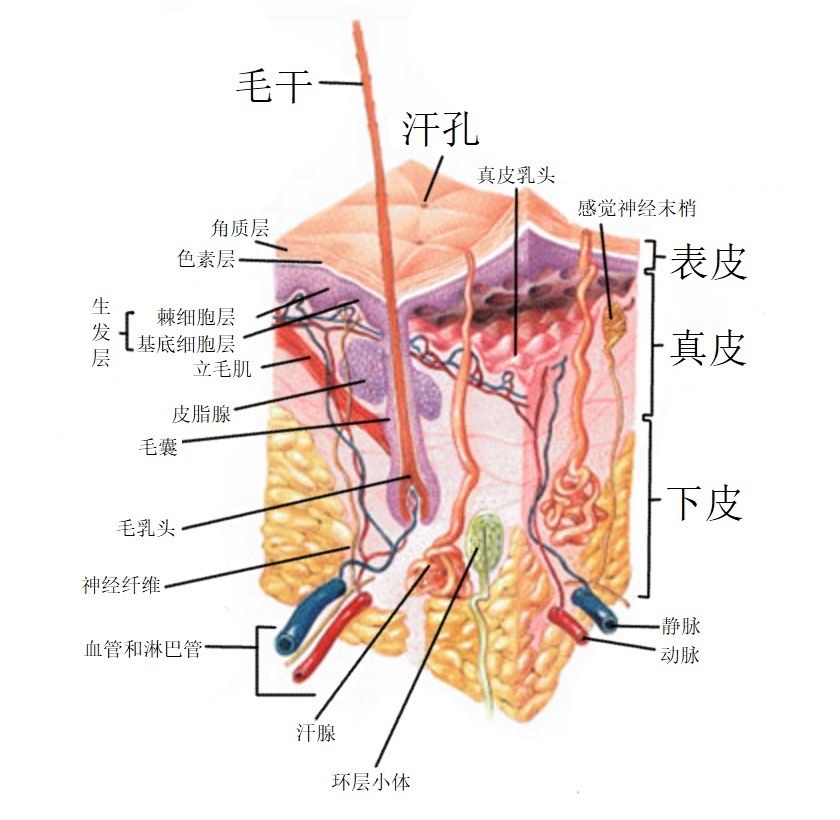
皮肤是由表皮、真皮、皮下组织、皮脂腺和汗腺组成。皮肤限制物质进出的屏障主要是来源于角质层的紧密结构,小分子物质和兼具脂溶性和水溶性的物质更易于渗透,一些物质可以自由穿过角质层
在使用过程中化妆品的功效成分作用于皮肤表面或者到达不同皮肤层,在该部位积聚并发挥功效性作用的过程即为透皮吸收。
透皮吸收主要有角质层、毛囊、汗管及皮脂腺 4 条途径,其中毛囊、汗管和皮脂腺常被称为旁路途径,因为皮肤附属器与整个皮肤表面积的比不足 1%,难以通过角质层的大分子物质和离子型物质可以经这 3 个途径进入皮肤。角质层透皮途径又可分为 2 种:细胞间途径与跨细胞途径。
细胞间路径:化学物质通过角质细胞间连续分布的细胞间脂质透入皮下,阻力主要来源于细胞间隙的脂质,阻力小于跨细胞途径,经皮渗透中起到主要作用
跨细胞途径:化学物质直接穿过角质细胞本身(细胞膜、细胞质、胞核),需要在亲水性和亲脂性之间不断转换
Analytical Method for the Detection of Recombinant Collagen in Complex Biological Matrices
复杂基质中重组胶原蛋白检测方法
文章中介绍了复杂基质中重组胶原蛋白的检测方法原理和应用,以及国家发布了一系列检测标准
Recombinant Collagen, Collagen Analytical Method
背景
每个行业的爆发都是长期积累的结果,胶原蛋白成为现在最火的重组多肽也经历了很多年,最最重要的还是重组工业化的突破以及市场逐渐的认可,其中每一份的努力都应该值得被尊敬。
《化妆品安全技术规范》尚未收录关于化妆品用原料重组胶原蛋白定义及其含量的检测方法标准。可复美胶原含量添加的争议让国家对重组胶原蛋白的检测开始重视,开始积极的开会研讨可统一的科学标准。
化妆品市场进入科学护肤时代,科技力成为消费者关注的焦点,新消费需求下的成分创新成为趋势。其中,合成生物技术为原料创新提供了新方向。对于重组胶原蛋白这一创新成分,消费者追求高功效的同时,安全性也十分关键。
为验证产品是否安全、功效是否真实,成分检测成为产品质量监督的重要手段。值得注意的是,目前针对重组胶原白的检测国家尚未出台统一的标准,如何科学、精准地对重组胶原蛋白成分进行权威科学检测成为行业探讨的话题。
5月30日,中国生物工程学会科创中国工作委员会联合昌平合成生物制造转化加速中心举办了“复杂基质中重组胶原蛋白检测方法”研讨会。会议是北京的专家们围绕复杂基质中重组胶原蛋白的分离与技术挑战、高灵敏度及高特异性检测方法验证、标准化检测体系的建立与行业监管需求等主题,解析技术难点。
重组胶原蛋白的应用
现在胶原蛋白比较认可的应用包括:
- 医药行业
- 促进表皮细胞的生长,促进伤口愈合,缩短愈合时间
- 烧伤,烫伤病患的伤口
- 皮下注射
- 化妆品行业
- 小分子胶原蛋白滋润肌肤,补充皮肤所需氨基酸
- 维护受损肌肤
- 保湿稳定泡沫,调节和稳定pH,乳化胶体
- 抗衰
- 毛囊干细胞及黑色素干细胞的调节
- 材料
- 生物聚合物,与其它亲水性聚合物混合形成高质量水凝胶和可生物讲解的支架
- 胶原蛋白膜可以作为屏蔽膜和愈合材料
- 胶原蛋白交联成皮革
胶原蛋白的功效经过多年科研和临床研究中已经被多方位证实。从功效机理来看,胶原蛋白在人体中主要通过胶原纤维对组织结构的支撑、细胞营养作用,以及针对有相应有受体的细胞产生的信号作用(包括相关细胞信号通路的激活,细胞增殖能力的提升,相关活性物质的分泌等等),在个体层面体现出填充、抗皱,修护,嫩肤,亮肤、等功效。
还有很多胶原蛋白肽的功能特性及应用,包括在医疗和食品中
重组胶原蛋白的合成研究进展
《重组胶原蛋白生物材料命名指导原则》对重组胶原蛋白的命名和分类进行规范。将重组胶原蛋白生物材料分为三大类:
- 重组人胶原蛋白:采用 DNA 重组技术制备的由人胶原蛋白特定型别基因编码的全长氨基酸序列且具有三螺旋结构的重组胶原蛋白
- 重组人源化胶原蛋白:由DNA重组技术制备的人胶原蛋白特定型别基因编码的全长或部分氨基酸序列片段,或是含人胶原蛋白功能片段的组合
- 重组类胶原蛋白:由DNA重组技术制备的,含有人特定或不同类型胶原蛋白部分基因编码及人工设计的基因编码,经基因编辑、组合、拼装等制备的胶原蛋白类似物,其基因编码序列或氨基酸序列与人胶原蛋白的基因编码序列或氨基酸序列同源性很低,但具有与胶原蛋白相似的理化性质和生物学功能。
在另一个博客中概述了范代娣教授的胶原蛋白合成综述,这里简短描述一下胶原蛋白的表达体系
缺乏动物细胞中胶原蛋白翻译后修饰,需要添加相对应的重组酶
常用的载体包括pGE、pET系列,虽然缺少羟基化过程,但是加入酶后仍能产生较为稳定的三螺旋蛋白结构(Shi et al. 2017)
大肠杆菌不同启动子,不同菌株表达影响(Yin et al. 2003)
未羟基化胶原蛋白相较于天然羟基化胶原蛋白的 Tm 值低10 ℃,对于使用大肠杆菌等表达体系高效表达存在重大障碍,添加P4H基因
利用人Ⅲ型部分胶原蛋白编码基因(COL3A1)与病毒源的赖氨酰羟化酶 L230 基因和脯氨酸羟化酶 L593 基因在大肠杆菌中共表达,获得了与人体胶原蛋白羟基化相似的胶原蛋白
真核生物,对分泌重组蛋白进行修饰,不含病热源、病毒包涵体
毕赤酵母与其它酵母相比,所翻译加工的重组胶原蛋白具有二硫键、糖基化、蛋白水解过程等优势
同源胶原三聚体容易,异源三聚体(I型)难
植物表达体系具备光合作用自产能力,其表达胶原蛋白成本相对较低
烟草植物细胞表达
玉米种子表达
表达量少,生产周期长,表达成本较高
杆状病毒作为表达载体感染昆虫、幼虫来获得重组真核蛋白
蚕后腺细胞
Sf9昆虫细胞
产量低,培养要求高但是有完整的三螺旋和好的热稳定性
小鼠乳腺细胞
纤维肉瘤细胞 HT1080
胚胎肾细胞 HEK293细胞
1. 样品前处理
与敷料类医疗器械和生物样本相比,化妆品中的重组胶原蛋白检测更复杂。化妆品中添加了植物提取物、蛋白质、多糖、脂类、表面活性剂及色素等多种成分,会严重干扰胶原蛋白信号,导致检测时其信号较弱。同时,化妆品中胶原蛋白添加量通常较低,对低浓度物质进行定量检测难度大。
是否其它多肽或者蛋白质类添加物也会存在这样的问题?只是标准未明确,而不是无添加无效果
2. 胶原蛋白含量检测方法
不同的蛋白检测方法各有特点,均有其适配的应用场景,无关乎方法开发出来的新旧,关键还是根据不同的基质,不同的溶剂,建立合适样品前处理方法,有效排除基质的干扰,选择和建立针对复杂基质的检测方法,并通过方法学验证其检出限、定量限、线性、精密度、准确性及检测回收率。
由于胶原蛋白家族的多样性,不同胶原蛋白的不同氨基酸序列,结构包括动态变化和相互作用进行研究和验证;以及蛋白降解的问题。
| 化妆品 | 医疗器械(敷料) | 生物胶原蛋白 | |
|---|---|---|---|
| 样品形态 | 膏、霜、乳、精华液、面膜、喷雾水、凝珠、冻干品 | 水凝胶、水胶体、止血材料、填充材料 | 细胞培养过程分泌 |
| 可能组成 | 水、有机溶剂、防腐剂、粘稠剂、植物提取物、动物蛋白、多糖、表活、酶 | 水、有机溶剂、粘稠剂、动物蛋白、多糖、高分子材料 | 细胞外基质、组织液、培养液 |
| 潜在反应 | 多酚/黄酮/异黄酮、糖基化、蛋白聚集/降解 | 糖基化修饰、聚集、降解 | 生物酶 |
| 可能产物 | 蛋白水解产物、蛋白偶联、蛋白聚集 | 蛋白聚集、蛋白降解 | 蛋白降解 |
| 检测目标 | 重组胶原蛋白 | 重组胶原蛋白 | 胶原蛋白及降解物 |
近几年胶原蛋白标准的推动
2021年4月,国家药监局发布《重组胶原蛋白类医疗产品分类界定原则》
2022年1月,YY/T 1849-2022《重组胶原蛋白》行业标准正式发布
2023年,YY/T 1888-2023《重组人源化胶原蛋白》
2023年5月,国家药监局发布了《重组胶原蛋白创面敷料注册审查指导原则》
下表中是医疗器械中胶原蛋白检测标准。
| 分类 | 检测项目 | 检测方法 |
|---|---|---|
| 理化性质 | 外观 | 白色/淡黄色/无色透明液体 |
| 水溶性/盐溶解性 | 0.1-10-100mg/mL | |
| 水分 | 《中国药典》 0832水分测定法 第二法烘干法 | |
| 炽灼残渣 | 《中国药典》 0841炽灼残渣检查法 <0.2% | |
| 酸碱度 | 《中国药典》 0631pH值的测定 5.5~8.0之间 | |
| 等电点 | 《中国药典》 0542 毛细管电泳法 | |
| 渗透压摩尔浓度 | 《中国药典》 0632渗透压摩尔浓度测定 | |
| 总蛋白含量 | 《中国药典》0731 蛋白质含量测定法 第一法 标识的90%~110% | |
| 纯度 | 《中国药典》 0514分子排阻色谱法/0512高效液相色谱法 | |
| 装量 | 标示装量的百分比 | |
| 鉴别 | 氨基酸序列确定 | |
| 肽段覆盖率 | 肽段覆盖率应为100%,酶解 | |
| 末端氨基酸序列 | ||
| 肽图 | ||
| 分子量 | 《中国药典》 3405肽图检查法 第一法 | |
| 杂志、污染物和添加剂 | 外源性DNA残留量 | YY/T1849-2022 5.5.2 |
| 大肠杆菌蛋白残留量 | 《中国药典》3412 或经验证的酶联免疫试剂盒 0.1~0.05% | |
| 酵母蛋白质残留量 | 《中国药典》3414 或经验证的酶联免疫试剂盒 | |
| CHO细胞蛋白质残留量 | 经验证的酶联免疫试剂盒 | |
| 肽聚糖 | 细菌肽聚糖检测试剂盒 | |
| 添加剂 | ||
| 重金属及微量元素 | 《中国药典》 0821重金属检查法 Pb,As,Hg,Cu,Mo,Ni | |
| 残余抗生素含量和活性 | 《中国药典》 1201抗生素微生物检定法或3408抗生素残留量检查法 50ng/mg | |
| 微生物限度 | 《中国药典》 1105、1106 | |
| 细菌内毒素 | 《中国药典》 1143细菌内毒素检测法 植入5EU 接触高一些 | |
| 结构表征 | 氨基酸异质性(脱酰胺化、氧化、糖谱/糖基化修饰) | YY/T 1849-2022 5.7.1、5.7.8 |
| 脯氨酸羟基化 | YY/T 1849-2022 5.7.7 | |
| 圆二色光谱 | YY/T 1888-2023 附录B | |
| 红外光谱 | 《中国药典》 0402红外分光光度法 | |
| 拉曼光谱 | 《中国药典》 0421拉曼光谱法 | |
| 稳定性 | ||
| 生物学评价 | GB/T16886.1 | |
| 免疫学评价 | GB/T16886.20、YY/T1465 |
2.1 光谱分析法
胶原蛋白肽是胶原蛋白水解的产物,成分组成与胶原蛋白一致,它们的区别在于胶原蛋白是高分子且具有三螺旋空间结构,而胶原蛋白肽是小分子。
- 紫外-可见光分光光度计
运用紫外线(UV)吸光度测定蛋白浓度是一种相对简单的蛋白定量测定法。含芳香族侧链的氨基酸(如色氨酸,酪氨酸等)使蛋白在280 nm处出现独特的紫外线吸光度。这些氨基酸在280 nm处吸收了紫外线,由此可以通过分光光度计获得该特定波长处的吸光度,用于估算样品中的蛋白浓度。


通过Warburg-Christian法估算蛋白浓度
mg蛋白/mL = [(1.31 x A280) - (0.57 x A260)] x 稀释因子
由此可见胶原蛋白富含甘氨酸(Gly)、脯氨酸(Pro)和羟脯氨酸(Hyp),但色氨酸(Trp)和酪氨酸(Tyr)含量极低,苯丙氨酸(Phe)也较少。紫外吸收280 nm主要依赖于Trp和Tyr。胶原蛋白因缺少这些残基,其在280 nm的吸收极弱,导致 低估蛋白浓度。
- 双缩脲法(Biuret Assay)法

双缩脲,也称氨缩脲、缩二脲等,它是两个分子脲(即尿酸)在180℃左右加热条件下脱出一个氨后缩合形成的一种有机物,分子内含有两个领接的肽键,其在碱性溶液中可与Cu2+发生络合反应生成紫红色络合物,这种反应称为双缩脲反应。
氨基酸通过肽键(-CO-NH-)相连而形成的化合物称为肽(peptide),,同样可以在碱性条件下与Cu2+发生双缩脲反应生成紫红色络合物,溶液颜色的深浅与蛋白质浓度相关,与蛋白质分子量及氨基酸成分无关,且溶液在540nm处的吸光度值与蛋白质含量在一定范围内具有良好的线性关系,因此可以利用此法测定蛋白质浓度。
- 不依赖芳香族残基
- 灵敏度比较低
- 某些缓冲液的干扰
- Lowry法检测蛋白
Lowry 法的显色原理是根据双缩脲反应,蛋白质中的肽键在碱性条件下与Cu2+反应,生成紫红色Cu+复合物。Folin-酚试剂在Cu+的催化下,磷钼酸磷钨酸盐被蛋白质中的芳香族氨基酸残基还原,产生深蓝色的钼蓝和钨蓝混合物,其最大吸收峰在745~750nm处。在一定的浓度范围内,所形成蓝色的深浅与蛋白质含量之间有线性关系,可用于蛋白质含量的测定。
- 由于产生的混合物的蓝色强度部分取决于酪氨酸和色氨酸含量,而它们在各种蛋白质中含量不同,因此会随不同的蛋白质而出现显色深浅的变化。
- 在Lowry法中,由于加入Folin- 酚试剂强化了双缩脲反应,使得显色量增加,检测灵敏度提高且比较恒定
- 二喹啉甲酸(BCA)法
BCA (Bicinchoninic Acid Assay) 蛋白定量是通过比色检测进行总蛋白质定量的常用方法,又被称为Smith法,因为它是由Pierce公司的Paul K. Smith等人在1985年发明的。后来,Pierce公司被赛默飞世尔科技公司收购。
BCA 蛋白定量试剂通过在碱性环境中用蛋白质将 Cu2+ 还原为 Cu+(广为人知的双缩脲反应),然后通过二辛可宁酸(BCA)对亚铜阳离子(Cu+)进行高灵敏度和高选择性的比色检测。单个氨基酸和二肽在双缩脲反应中不受影响,但三肽以及更大的多肽或蛋白质会发生反应,产生吸收峰位于 540 nm 的淡蓝色至篮紫色复合物。一个二价铜离子与附近四到六个多肽结合形成有色螯合物。产生的颜色强度与参与反应的肽键数目成正比。


- 单个氨基酸和二肽在双缩脲反应中不受影响
- 更加灵敏
- 兼容性有提升,但是对还原剂敏感
- Bradford考马斯亮蓝染色法
Bradford 法又称考马斯亮蓝法,用于快速,简便的蛋白质定量。这种定量方法在室温进行,无需特殊仪器。将配制好的考马斯亮蓝 G-250 检测试剂加入标准品和待测样品中,经过短暂的室温孵育即可在 595 nm 处测定吸光值。Bradford 法蛋白定量与蛋白质样品中常见的盐离子、溶剂、缓冲液、硫醇、还原性物质和金属螯合剂相兼容。
在酸性环境中,蛋白质结合考马斯染料。这导致染料的最大吸收发生位移,从红棕色形式(最大吸收峰 465nm)转化为蓝色形式(最大吸收峰 610nm)。染料的两种形式在 595nm 处差异最大,因此 595nm 是测定考马斯染料-蛋白复合物的蓝色的最佳波长。
- 颜色的形成是与某些碱性氨基酸(主要是精氨酸、赖氨酸和组氨酸)有关
- 游离氨基酸、肽和低分子量蛋白质不会与考马斯染料试剂产生颜色
- 和去垢剂不兼容,会导致试剂形成沉淀
2.2 色谱/质谱法
高效液相色谱法(High Performance Liquid Chromatography,HPLC)是一种用于分离、鉴定和定量化合物的技术,广泛应用于各种样品的分析,包括蛋白质。在蛋白质定量方面,HPLC提供了一种准确、重复性好的方法,能够处理复杂的生物样品
液相质谱法基于特征多肽鉴定的胶原蛋白多肽检测,是一种通过鉴定胶原蛋白特异的多肽片段来检测胶原蛋白的方法。该方法基于液相色谱-质谱联用技术(LC-MS/MS),通过检测肽段的质谱信号来定性和定量样品中的胶原蛋白多肽
将胶原蛋白试样溶解,加热变性后进行胰蛋白酶酶解,释放特征多肽;再用液相色谱质谱法测定。 以不同类型胶原蛋白特征多肽的保留时间和二级子离子碎片的质荷比进行定性和确证,用外标法或内 标法进行定量。

- MALDI-TOF: 通过激光解析样品,胶原蛋白分子被电离并加速飞行,根据飞行时间的差异进行分离和鉴定
- ESI-MS/MS: 通过电喷雾电离胶原蛋白分子,然后通过串联质谱进行多级破碎,获取胶原蛋白的序列信息
虽然精度很高,但是低浓度的误差也会变大
2.3 免疫学法
- 酶联免疫吸附试验(ELISA)
ELISA(酶联免疫吸附检测)是一种平板检测技术,旨在检测和定量肽、蛋白质、抗体和激素等物质。在 ELISA 中,抗原必须固定化到固体表面,然后与连接到酶的抗体混合。通过与适当的底物孵育,测量报告基因酶的活性来产生可测量的产物,从而实现检测。
现在基本上分为三类,最常用的是夹心法 - 直接法 - 间接法 - 夹心法

- 将胶原蛋白作为抗原进行检测,根据标准曲线来获得胶原蛋白的量,灵敏度高。
- 免疫荧光/免疫印迹
根据胶原蛋白的特异结构,不会发生交叉(这是免疫学的基础)。利用抗原-抗体特异性反应,检测蛋白质的表达和翻译后修饰;免疫印迹法是一种常用的蛋白质鉴定方法,适用于分析细胞内特定蛋白质的表达水平。只能用来相对定量/半定量
2.4 氨基酸分析仪
用来进行蛋白质、肽及其他药物制剂的氨基酸组成或含量的测定的仪器,称为氨基酸分析仪。必须先蛋白质及肽水解成单个氨基酸,然后再进行氨基酸分析。
基本原理:氨基酸混合物在流动相(缓冲溶液)的推动下从装有阳离子交换树脂的色谱柱流经流经,各氨基酸与树脂中的交换基团交换离子。当洗脱时使用的pH缓冲溶液不同时,氨基酸混合物由于不同的交换能力而分离,分离出的单个氨基酸组分与茚三酮试剂发生反应,生成紫色化合物或黄色化合物,其在570nm、440rnn的吸光度用可见光检测器进行检测。这些有色产物对应的吸收强度与洗脱出来的各氨基酸浓度之间的关系和朗伯-比尔定律相符合。以此为依据可以定性、定量分析氨基酸各组分氨基酸分析仪也可利用阴离子交换分离后经积分脉冲安培法检测。
特异性氨基酸
胶原蛋白的(Gly-x-y)结构组成决定了它的检测独特性
- 羟脯氨酸:使用水解后羟脯氨酸的含量来推算胶原蛋白的含量
- 甘氨酸:1/3的含量来推算胶原蛋白的含量
所有的氨基酸水解效率都能影响蛋白质的含量,只有交叉验证来减少误差。不同来源胶原肽羟脯氨酸含量不同,换算系数也不同。利用羟脯氨酸测定胶原肽含量的方法有比色法、氨基酸分析仪法、高效液相色谱法、毛细管电泳法等,其中比色法、电泳法较多用于含量检测,而氨基酸分析仪法和高效液相色谱法还可用于分析胶原蛋白的氨基酸组成
3. 透皮吸收
透皮吸收:指功效成分作用于皮肤表面或者到达不同皮肤层,在该部位积聚并发挥功效性作用的过程。化妆品与药物“透皮吸收”的差异体现在化妆品功效性成分是以积聚并作用在皮肤层为最终目的,不需要进入体循环
500Da分子量作为透皮吸收的分界线,500Da相当于四个氨基酸分子量的小分子。
还是需要借鉴药物经皮吸收渗透的研究方法
- 扩散池法
- 胶带剥离技术光谱法
- 光谱法
- 功效检测法