- 新鲜状态的胶原纤维集合成束时,肉眼观呈有光泽的白色(旧称“白纤维”)
- 能分泌胶原纤维的细胞种类很多,常见的有成纤维细胞、成骨细胞、成软骨细胞、平滑肌细胞、网状细胞等
- 在电镜下,胶原纤维束由多根胶原原纤维构成,原纤维之间有微量黏合物质,借助糖分子显示的方法能看得更清楚。胶原原纤维有周期横纹,间距64 ~ 69 nm
- I型胶原蛋白常见于骨、皮肤、肌腱、器官被膜等处,可形成粗而长的典型胶原原纤维。IV型胶原蛋白见于上皮基膜,不形成典型的原纤维结构,也看不见周期性横纹
Abstract
近日,微博大V时尚美妆博主大嘴博士在社交媒体上发布”巨子生物疑似造假,重组胶原竟然监测不到胶原”的视频,一石激起千层浪,可复美和巨子生物被推上了风口浪尖。可复美在24日的声明中指出,公司已参考中国医药行业标准YY/T 1947-2025《重组胶原蛋白敷料》中重组胶原蛋白含量的检测方法对相关产品进行检测,多批次检测结果胶原蛋白含量均大于0.1%。涉及到重组胶原蛋白,巨子生物以及胶原蛋白检测方法等,还是有梳理的必要性,此文章主要围绕这三个部分。
1. 胶原蛋白总览
胶原蛋白是最古老、最丰富的细胞外基质蛋白,在食品、化妆品、制药和生物医学行业有广泛的应用(Sorushanova et al. 2018)。
总览了胶原蛋白家族和它们各自结构,组成和生物合成;各类胶原蛋白制剂(例如哺乳动物/海洋生物提取的胶原蛋白、细胞产生的胶原蛋白、重组胶原蛋白和胶原蛋白样肽)和交联技术(例如化学、物理和生物)的进展和不足之处。
研究了一系列结构、热、机械、生化和生物学检测方法,以分析和表征胶原结构
1.1 胶原蛋白介绍
胶原蛋白”一词诞生于 19 世纪,指的是结缔组织中的一种成分,煮沸后会产生明胶。
“colla” 来自希腊语 kólla(κόλλα),意思是”glue”(胶水)
“-gen” 来自希腊语 -genēs(-γενής),意思是”to produce”或”producing”(产生)
胶原蛋白是主要的细胞外基质 (ECM) 分子,可自组装成横纹原纤维,为细胞生长提供支持,并负责结缔组织的机械弹性
胶原蛋白在人体组织中的普遍性和各种固有特性(例如细胞识别信号、形成各种物理构象的 3D 支架的能力、可控的机械性能和生物降解性)使其成为各种临床适应症的组织工程支架原材料的自然选择。主要是I型和II型胶原蛋白作为组织的主要材料
1.2 胶原蛋白家族
“胶原蛋白”这一统称涵盖了整个糖蛋白家族,其特征有三个:
- 有或者无间断的 [Gly-X-Y]n 重复序列
- 脯氨酸(proline)及其羟基化形式羟脯氨酸(hydroxyproline)分别占据 X 和 Y 位置
- 胶原单链本身是左旋的,三条链长度一致,整体的三股螺旋呈右旋方向
有趣的是,尽管有些分子不是真正的胶原蛋白,但是他们也采用了类似胶原三螺旋结构,在数据库搜索给出了其他含胶原样结构的蛋白;
adiponectin(脂联素):调节血糖、脂肪代谢
collectins(凝集素):参与免疫识别
EMILINs:细胞外基质中的蛋白家族
C1q 是补体系统中经典途径的关键识别蛋白,其结构特征包括一个胶原样区域(collagen-like region)和一个球状头部区域(globular head region)等
1.3 胶原蛋白结构和组成
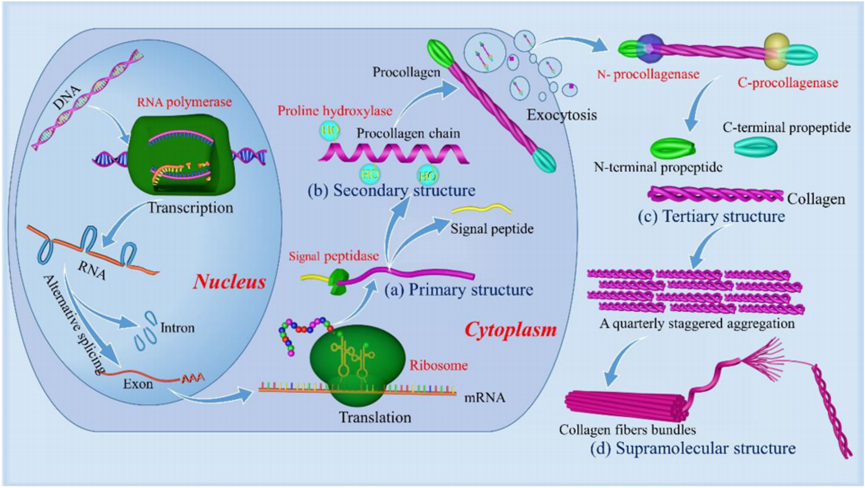
胶原蛋白分子是由一个三螺旋区域和两端两个非螺旋区域组成(9-26个氨基酸在N端和C端)。三螺旋构象是所有胶原蛋白的决定性结构元素,如图 Figure 2 所示,胶原蛋白三螺旋(三级结构)具有由三条平行的α多肽链(二级结构)组成的卷曲螺旋结构,这些多肽链以规则的螺旋相互缠绕,形成分子量约为300 000 g mole−1(300kDa)、长度为280 nm、直径为1.4 nm的绳状结构
这里的三螺旋是胶原蛋白最最基础的结构,是后续组成原胶原(在细胞内合成时,两端还有非螺旋的肽段,分泌到细胞外后被蛋白酶剪切,生成成熟的三螺旋 tropocollagen 分子),胶原原纤维(多个三螺旋分子按有序重叠方式(四分之一偏移 staggered array)排列,形成有条纹的细丝结构),最后构成胶原纤维(Collagen fiber)
| 项目 | 胶原原纤维 Collagen fibril | 胶原纤维 Collagen fiber |
|---|---|---|
| 层级 | 中间层级 | 最外层宏观结构 |
| 构成单位 | 由多个 三螺旋分子 聚合 | 由多个 原纤维 聚集而成 |
| 粗细 | 直径几十~几百纳米 | 直径可达几微米 |
| 可见性 | 需电子显微镜(EM)观察 | 可用光学显微镜观察 |
| 结构特点 | 有67 nm条纹结构(周期性) | 无条纹,外形粗大 |
| 功能 | 提供微观支撑结构 | 提供宏观强度和组织形态 |
| 示例部位 | 真皮中微结构,肌腱细丝 | 皮肤/肌腱中可见纤维束 |
甘氨酸对于稳定三螺旋起到至关重要的作用 Figure 2
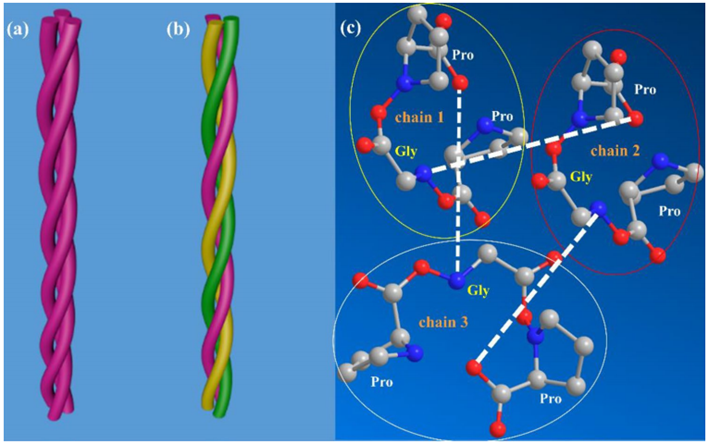
Figure 3 更能直观地看到每个三肽重复单位(triplet)**中,存在 两个氢键,它们在胶原链之间起到稳定作用
- 甘氨酸(Gly)的氨基 与 邻链中第二位氨基酸(X)的羧基
- 水分子、第三位氨基酸(Y,通常为羟脯氨酸)上的羟基(–OH)
蛋白质的二级结构是指肽链的主链折叠产生的局部空间构象。氨基酸残基间的相互作用形成了胶原蛋白的二级结构,其中Pro和Hyp之间存在静电相互作用导致肽链形成左手螺旋。三条肽链进一步组装成具有右手螺旋的三螺旋结构,氨基酸残基之间的氢键可维持螺旋结构的稳定性
Figure 1 在胞外环境中,羧基肽酶和氨基肽酶水解两端的附加肽,形成成熟的胶原蛋白原。在范德华力、氢键和交联反应的作用下,胶原蛋白分子纵横交错、平行排列,形成高聚合的胶原纤维
flowchart LR A(Tropocollagen 分子三股螺旋) --> B(胶原原纤维Collagen Fibril) B(胶原原纤维Collagen Fibril) --> C(胶原纤维Collagen Fiber) C(胶原纤维Collagen Fiber) --> D(胶原纤维束Fiber Bundle)
Gly–Pro–Hyp 序列最为常见(约占 12%),Gly–Pro–Y 和 Gly–X–Hyp 形式的序列约占 44%,Gly–X–Y 序列则占剩余的 44%。脯氨酸和羟脯氨酸因其脂环族结构,可以稳定胶原蛋白分子,并通过阻止其围绕 C-N 键旋转来增强 α 链的刚性
当胶原分子沿轴向以一定规律排列时,形成一种重复性结构,在电子显微镜下呈现出明暗相间的横向条纹,称为 D 带(周期约为 67 nm。这种条纹来源于交替的”重叠区(overlap)“和”缺口区(gap)“,通过原子力显微镜(AFM)对大胶原纤维表面进行形貌分析,证实了脊状结构与 5-15 纳米深的凹槽交替存在,周期为 60-70 纳米(Peñuela et al. 2018)
1.4 胶原类型
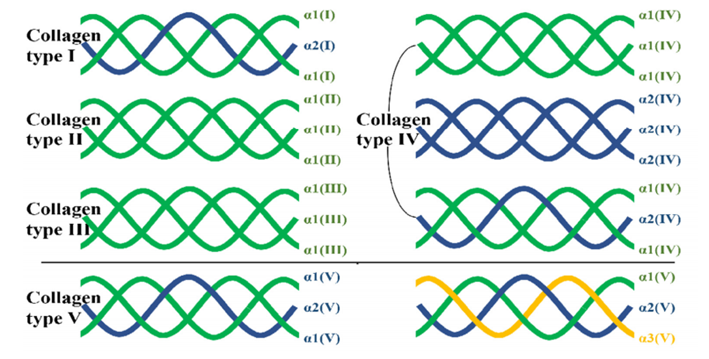
到目前为止,已鉴定出 40 种脊椎动物胶原蛋白基因,形成 29 种不同的同源和/或异源三聚体分子。
罗马数字用于指示类型,希腊字母用于标识链条、带子和较高分子量的组分。单个胶原蛋白类型中也存在异构体。例如,大多数I型胶原蛋白以两条α1链和一条α2链的异三聚体形式存在,但也存在三条α1链的同三聚体形式存在。
许多类型的胶原蛋白,例如 II 型、III 型或 VII 型,都仅以同型三聚体的形式存在。而 IV 型胶原蛋白则恰恰相反,它有六种不同的 α 链可供组合,形成大量异构体,从而形成组织特异性的基底膜。
据胶原蛋白所形成具有不同活性的形态结构可将胶原蛋白类型大致分为纤维性胶原蛋白(Ⅰ、Ⅱ、Ⅲ、Ⅴ、Ⅺ、ⅩⅪ、ⅩⅩⅦ型)与非纤维性胶原蛋白(Ⅳ、Ⅵ、Ⅶ、Ⅷ、Ⅸ、Ⅻ、ⅩⅢ、ⅩⅣ、ⅩⅤ、ⅩⅥ、ⅩⅦ、ⅩⅧ、ⅩⅨ、ⅩⅩ、ⅩⅪ、ⅩⅫ、ⅩⅩⅢ、ⅩⅩⅣ、ⅩⅩⅤ、ⅩⅩⅥ、ⅩⅩⅦ、ⅩⅩⅧ型)。其中非纤维性胶原蛋白可分为网状胶原蛋白、珠状丝状胶原蛋白、锚定纤维蛋白、膜蛋白以及 multiplexins 胶原蛋白
第一类是纤维型胶原包括Ⅰ、Ⅱ、Ⅲ、Ⅴ、Ⅺ、ⅩⅣ和ⅩⅩⅦ型,主要在体内广泛分布,其中Ⅰ、Ⅱ和Ⅲ型最为常见。它们都具有三重螺旋,其中不间断的 Gly–X–Y 延伸长度约为 300 nm,真皮、肌腱和其他组织中的胶原纤维通常是不同类型的胶原蛋白的混合物,通常是 I 型、III 型和 V 型。
第二类是三螺旋纤维型胶原(FACIT:fibril-associated collagens with interrupted triple helices),包括Ⅸ、Ⅻ、ⅩⅣ、ⅩⅥ、ⅩⅨ和ⅩⅫ型,这些胶原不形成纤维,但通过与其他胶原相互作用调节纤维的组装和大小,它们还可以通过限制横向共生生长来控制各种组织中胶原纤维的直径,就像 IX 型胶原蛋白一样。
第三类是网状型胶原,如Ⅳ、Ⅶ和ⅩⅩⅧ型,Ⅳ型形成纤维状网状结构,Ⅶ型则组装成锚定纤维,连接表皮与真皮。IV 型胶原蛋白形成纤维网状结构,而 VII 型胶原蛋白则通过反向平行二聚体结合,形成具有不同带状图案的横纹原纤维。非纤维胶原蛋白的一个显著亚类是跨膜胶原蛋白(XIII 型、XVII 型、XXIII 型和 XXV 型),其具有跨膜结构域,允许这些分子插入细胞膜,同时将(中断的)三螺旋结构域向外投射到细胞外空间。
第四类是含有短链胶原蛋白 VI 型、VIII 型和 X 型。它们因其三螺旋结构区域而得名,该区域分别延伸至100纳米和150纳米。VI型胶原蛋白形成串珠状微丝,而VIII型和X型胶原蛋白则形成六边形晶格。XXIX型胶原蛋白具有短而连续的三螺旋结构区域
1.5 胶原细胞合成过程
胶原蛋白生物合成途径,从基因转录到胶原蛋白单体的分泌和聚集形成功能性纤维,是一个复杂的多步骤过程,需要协调众多时间和空间协调的生化事件。
- 根据胶原蛋白类型和异构体,第一步是mRNA转录,3条α链基因
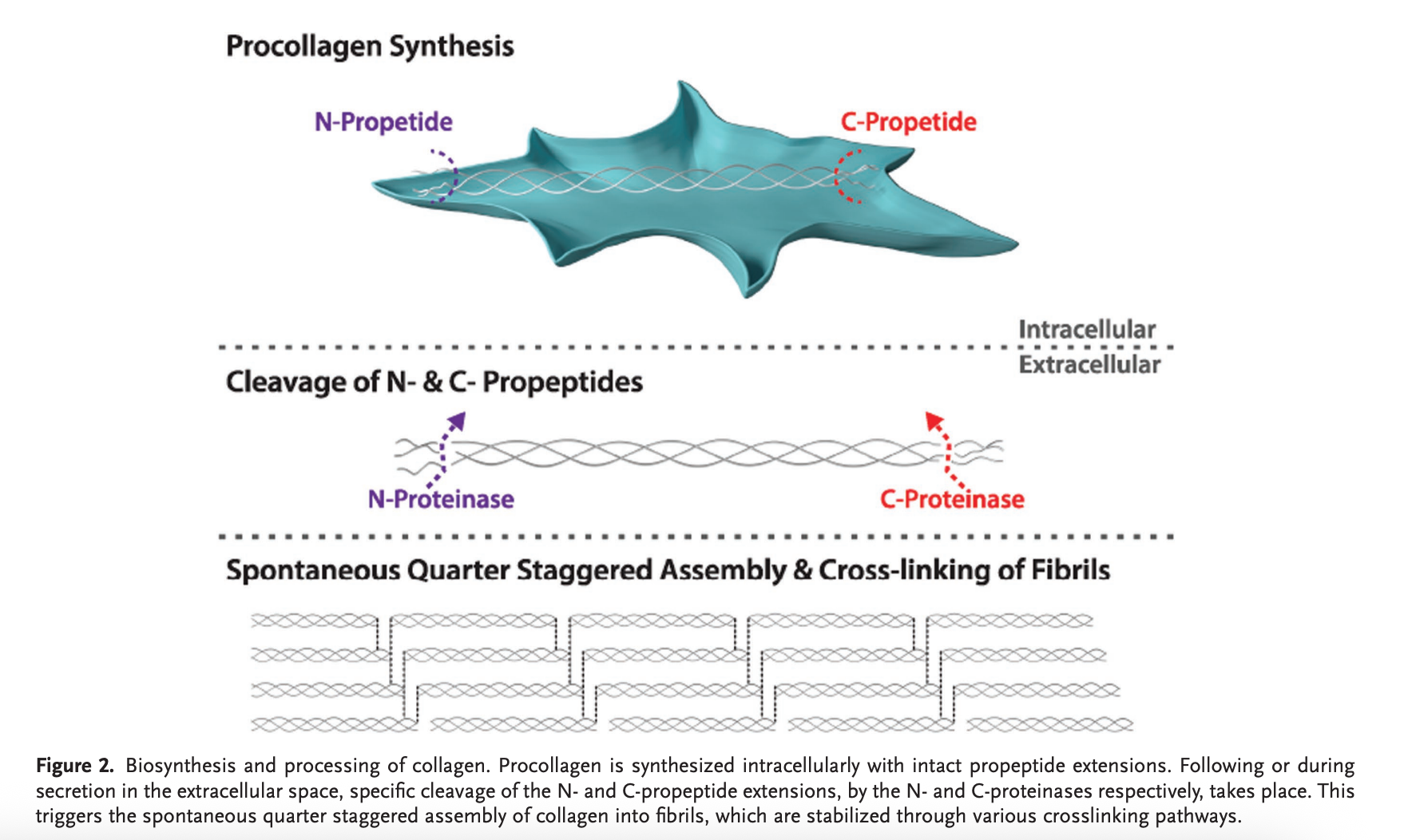
- 新生胶原α链首先以N端进入内质网腔,成为前原胶原,通过去除信号肽,转变为原胶原(Procollagen)
胶原蛋白生物合成的一个显著特点是合成从 N 端开始,而三螺旋的形成从 C 端开始(Raghunath, Bruckner, and Steinmann 1994)
胶原蛋白的两种主要翻译后修饰 (PTM),羟基化和糖基化,发生在内质网中,它们分别有助于三螺旋和组装形式的胶原蛋白的热稳定性和机械稳定性。
- 脯氨酸羟基化(脯氨酰 4-羟化酶):脯氨酸大约占氨基酸的10%,通常在Gly-X-Y的Y位置
- 酶促糖基化和赖氨酸羟基化(胶原蛋白中的糖成分要么是单个半乳糖单元,要么是半乳糖和葡萄糖)
- 各种辅助蛋白辅助折叠
- 前胶原蛋白(Procollagen)的蛋白分泌到细胞外水解裂解。N-和C-前肽在 Ca2+ 存在下,通过前胶原 N-蛋白酶和前胶原 C-蛋白酶。
- 细胞外超分子组装。酶法去除前肽后,产生的胶原三螺旋(也称为原胶原)能够形成超分子聚集体,存在两个模型解释
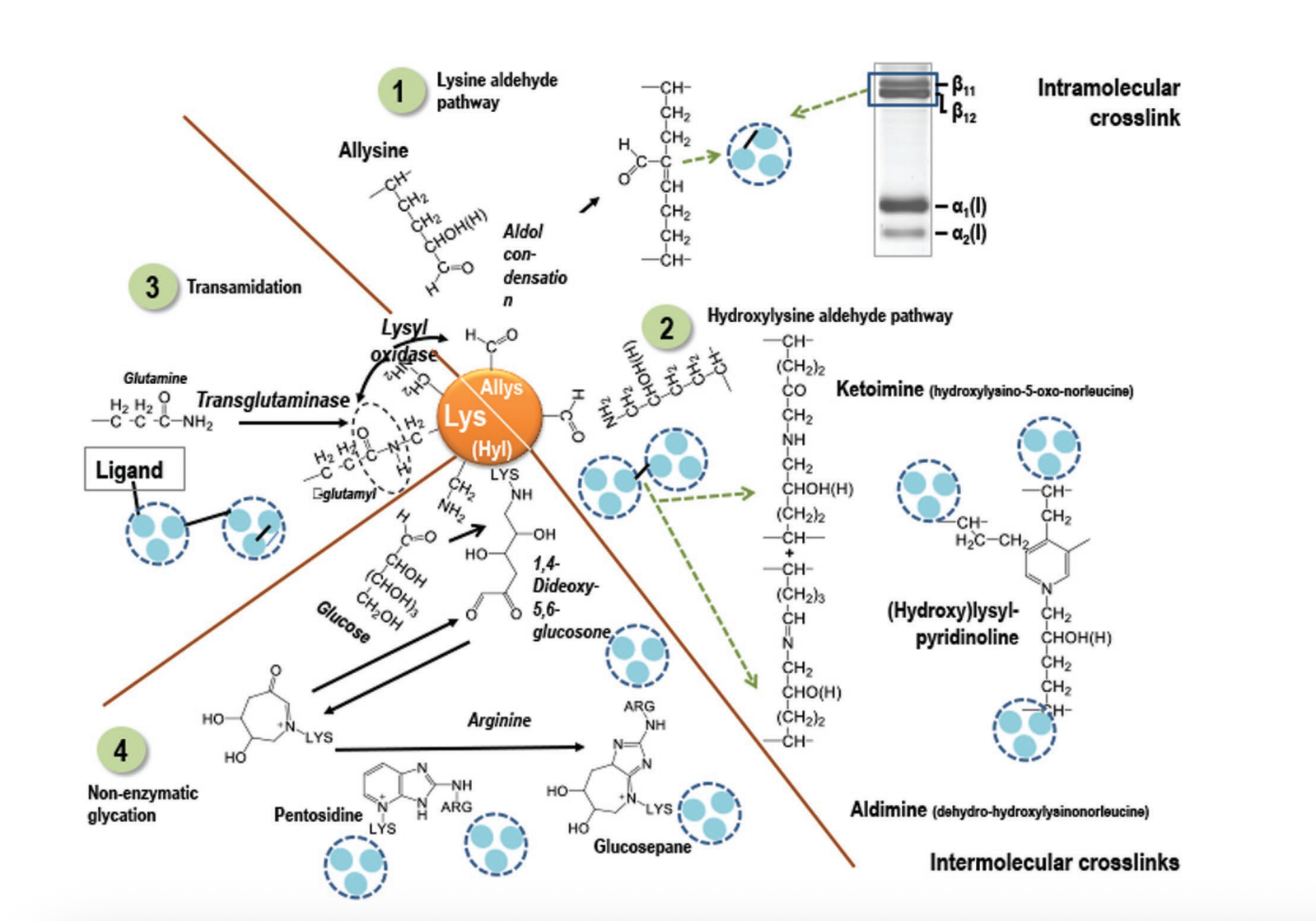
- 天然交联为胶原蛋白组织提供了结构稳定性、机械完整性和酶促弹性
- 赖氨酰氧化酶交联
- 糖介导交联
- 转谷氨酰胺酶交联
2. 胶原蛋白来源
在 Table 1 中展示了常见的胶原蛋白来源以及各自的优缺点,后面简单介绍一下各自的方法。
| 来源 | 优势 | 劣势 |
|---|---|---|
| 组织分离 |
|
跨物种传播疾病的可能性 |
| 细胞合成胶原蛋白 | 免疫相容性好 | 低产量 |
| 重组胶原蛋白 | 免疫反应低下 | 低产率、稳定性问题 |
| 用化学多肽合成法制备的胶原蛋白或其片段 | 排除了异体/异种来源的免疫排斥风险 |
|
2.1 分离胶原蛋白
对于生物医学应用,哺乳动物的皮肤和肌腱组织(猪、牛和羊来源)是 I 型胶原蛋白的主要来源,而 II 型胶原蛋白主要从牛、猪和鸡的软骨组织中提取。Type IV collagen is an important component of Episkin。值得一题的是,早期胶原蛋白使用鼠尾腱胶原蛋白,因为其纯度高,提取过程相对简单。无论物种/组织来源如何,胶原蛋白都因其庞大、连贯、共价交联的纤维网而闻名。
 {.lightbox width=“60%” fig-align=“center” fig-alt=” 胶原蛋白分离”}
{.lightbox width=“60%” fig-align=“center” fig-alt=” 胶原蛋白分离”}
牛和猪胶原蛋白的三螺旋结构域与人类胶原蛋白高度同源,但端肽区域的免疫学相关差异可能会引发免疫反应。尽管胃蛋白酶消化会切除非螺旋末端,但其免疫原性潜力并未完全消除。异种生物材料更大的担忧是传染性病原体的转移。
2.2 细胞生成胶原蛋白
由于胶原蛋白是由专门的细胞合成的,因此可以让培养的细胞产生这些必需的 ECM 分子,然后从培养基或沉积的细胞层中收获它们。
- 成纤维细胞生产胶原蛋白I
- 软骨细胞生产胶原蛋白II
- 提高产量的各种条件刺激
- 于胶原蛋白编码基因通过转录、翻译等作用形成新生胶原蛋白α链(称为前α 链)
- 胶原蛋白前 α 链在内质网中先后经历脯氨酸-4-羟化酶(P4H)与赖氨酸羟化酶(LH)的修饰作用使 Gly-Xaa-Yaa 中 Yaa 位上的脯氨酸残基与赖氨酸残基分别羟基化,而一部分羟基化赖氨酸残基则进一步糖基化(前 胶 原 蛋 白 α 链 还 需 要 脯 氨 酸 -3- 羟 化 酶(P3H)进行修饰)
- 3条胶原蛋白前 α 链的 C端前肽在内质网膜凝集素样分子伴侣、钙联蛋白和内质网氧化还原酶PDI的协同作用下形成的二硫键,并将胶原蛋白 α 单链三聚体化,形成三螺旋结构,构象从C端一直持续到N端
- 经胶原蛋白特异性分子伴侣 HSP47 作用后,前胶原蛋白被内质网出口 TANGO1 识别,运输到高尔基体中,在高尔基体中,HSP47 从前胶原蛋白解离,并通过 KDEL(REDL)受体返回内质网中。
- 高尔基体将前胶原蛋白运送分泌到细胞外基质,通过N端酶与C端酶的共同作用将前胶原蛋白多余N端与C端前肽进行切除,形成完整的胶原蛋白分子
2.3 重组胶原蛋白
利用微生物作为生产重组胶原蛋白的合理性在于,进化胶原蛋白和胶原蛋白样蛋白在多细胞生物中出现之前就存在于细菌中。酿酒酵母和毕赤酵母是最早被研究的酵母,能够糖基化。产量还是非常的低
- 15mg/L 酵母
- 60mg/L 杆状病毒
- 90mg/L 大肠杆菌
通过结合搅拌式生物反应器、高细胞密度和调节培养时间可以显著提高产量。细菌重组胶原蛋白的另一个缺点是缺乏羟脯氨酸。
尽管迄今为止取得了长足的进步,但单细胞生物无法产生细胞外基质 (ECM),因此缺乏翻译后修饰胶原蛋白的酶促工具箱。因此,在大多数情况下,产生的胶原蛋白在胃蛋白酶消化时不稳定,这表明三螺旋结构形成不完整或热不稳定性
2.4 合成胶原蛋白
合成的 Gly–X–Y 重复序列的三聚体结构,称为胶原蛋白模拟序列、胶原蛋白样肽或胶原蛋白相关肽,是解决与动物提取胶原蛋白、细胞产生的胶原蛋白和重组合成胶原蛋白相关问题的科学研究的前沿。尽管合成策略和技术的进步使得合成长链成为可能,但目前所有合成的三螺旋的长度均在 10 纳米以下,远远低于经典的 I 型胶原蛋白 α 螺旋长度 300 纳米
如果能够证明胶原蛋白合成生物材料的安全性和有效性,我们就能预见到一条非常有趣的构建胶原蛋白合成生物材料的途径
| 中文名 | 英文名 | 三字母缩写 | 单字母缩写 |
|---|---|---|---|
| 丙氨酸 | Alanine | Ala | A |
| 精氨酸 | Arginine | Arg | R |
| 天冬氨酸 | Aspartic acid | Asp | D |
| 天冬酰胺 | Asparagine | Asn | N |
| 半胱氨酸 | Cysteine | Cys | C |
| 谷氨酸 | Glutamic acid | Glu | E |
| 谷氨酰胺 | Glutamine | Gln | Q |
| 甘氨酸 | Glycine | Gly | G |
| 组氨酸 | Histidine | His | H |
| 异亮氨酸 | Isoleucine | Ile | I |
| 亮氨酸 | Leucine | Leu | L |
| 赖氨酸 | Lysine | Lys | K |
| 甲硫氨酸 | Methionine | Met | M |
| 苯丙氨酸 | Phenylalanine | Phe | F |
| 脯氨酸 | Proline | Pro | P |
| 丝氨酸 | Serine | Ser | S |
| 苏氨酸 | Threonine | Thr | T |
| 色氨酸 | Tryptophan | Trp | W |
| 酪氨酸 | Tyrosine | Tyr | Y |
| 缬氨酸 | Valine | Val | V |
3. 巨子生物
巨子生物成立于2000年,是一家立足科技美学的高科技企业,是中国基于生物活性成分的专业皮肤护理行业的先行者及领军者。聚焦功效性护肤品、医疗器械、功能性食品及特殊医学用途配方食品三大产业方向
公司借助专有的合成生物学技术平台自主研发和生产多种类型的重组胶原蛋白和多种稀有人参皂苷,拥有167项专利及专利申请。利用专有的合成生物学技术设计及开发重组胶原蛋白、稀有人参皂苷及其他生物活性成分
3.1 巨子生物历史
- 1999年范代娣博士留学回国,在西北大学组建科研团队,开始研发系列重组类人胶原蛋白
- 2000年巨子生物于西安高新区创业大厦成立,成功开发了重组胶原蛋白技术
- 2001年,巨子生物获得家科技部“科技型中小企业技术创新基金”支持;重组胶原蛋白“一种类人胶原蛋白及其生产方法”申请国家发明专利
- 2002年,获得国家科技部“火炬计划”项目支持;基因工程技术生产类人胶原蛋白中试”技术经专家鉴定为“国际领先”水平
- 2005年,专有重组蛋白技术,即一种类人胶原蛋白及其生产方法,在中国获得行业首个发明专利授权
- 2006年,巨子生物的第一期工厂(于2005年11月开 始建设)竣工,建筑面积约为3,450平方米,设计年产量约为16,830,000包”;范代娣教授入选“新世纪百千万人才工程国家级人选”
- 2007年,获批成立“西安市发酵生物材料工程技术研究中心”
- 2008年,西安高新区瞪羚谷生产基地投入使用
- 2009年,可丽金品牌创立,可丽金类人胶原蛋白系列产品进驻国家权威医疗机构
- 2010年,类人胶原蛋白项目荣获第19届“国家发明博览会金奖”、“国际发明家协会最佳创新奖”
- 2011年,可复美品牌创立,可复美类人胶原蛋白敷料获批Ⅱ类医疗器械注册上市
- 2012-2013年,各种国家级和省部级奖项
- 2015年,西安高新区上林苑生产基地开工建设,获批成立国家级“博士后科研工作站”
- 2016-2018年,各种国家省部奖项,产品,技术,企业和人
- 2019年,西安高新区上林苑生产基地正式投产
- 2020年,“稀有人参皂苷的生物制造及其应用”开始推出
- 2020- ,后续都是企业的各种荣誉和推广,以及资本的加持
- 2022年11月,巨子生物港股上市
3.2 创始人物介绍
范代娣主要从事极难化学合成医药分子的生物制造,聚焦大分子胶原蛋白及四环三萜类物质的合成生物技术及生物学功效、分子结构与功能、生物安全性等从基础研究(生物合成)——功能发现——产业化——应用的全链条研究,研究涉及新型医药原料、生物医用材料、预防医学和营养医学、新药等领域
丈夫:严建亚,男,汉族,1966年出生,中国国籍,大学学历。西安三角防务股份有限公司、西安巨子生物基因技术股份有限公司董事长、西安创客村电子商务有限责任公司创始人
- 1996年出生陕西省蒲城县
- 1984-1988 西北大学化学工程系攻读化学工程专业学士学位
- 1988年9月—1991年7月,在西北大学化工系攻读生物化工专业硕士学位
- 1991年9月—1994年7月,在华东理工大学生物工程系攻读生物化工专业博士学位
- 1994年7月,范代娣在西北大学化工系生物工程系从事教学和科研工作
- 1996年6月,被聘西北大学为副教授
- 1999年1月—2000年1月,在美国麻省理工学院国家生物工程中心从事高级访问学工作
- 2000年晋升为西北大学教授
- 2005年,任西北大学化工学院副院长
- 2007年,任陕西省生物材料与发酵工程技术研究中心主任
- 2008年,任陕西省可降解生物医用材料重点实验室(西北大学)主任
- 2021年8月,任西北大学化工学院院长
- 2023年8月,范代娣入选2023年中国工程院院士增选有效候选人名单
- 2025年4月,任西北大学副校长
3.3 核心技术
官网上宣称是3种全场重组胶原蛋白,25种功能强化型重组胶原蛋白,5种重组胶原蛋白功效片段;5种高纯度稀有人参皂苷每种均实现大规模生产(Rk3,Rh4,Rk1,Rg5及CK)
公司研发支出达到人民币 106.5 百万元,同比增长 1.9%,占营业收入的 42.1%。截至报告期末,公司在研项目共 188 项;公司已获授权及正在申请中的专利共 167 项。
- 重组IV型胶原蛋白(中国发明专利:ZL 202410545206.6)
- 重组人XVII型胶原蛋白、其制备方法及应用(ZL202410154497.6)
- 富含人参皂苷Rh4的人参发酵产物、其制备方法及应用(CN119265267A)
- 一种新的I型重组胶原蛋白、其生产方法及用途
- 一种新的重组人XV型胶原蛋白、其生产方法及用途
- 一种重组人VI型胶原蛋白、其生产方法及用途
- 重组人XXIII型胶原蛋白、其生产方法及用途
- 胶原蛋白产品中重组胶原蛋白的液相色谱-质谱检测方法
- 一种重组人II型胶原蛋白、其制备方法及用途(截短型)
- 一种重组XIV型胶原蛋白及其制备方法和应用
- 各种胶原蛋白和人参皂苷的应用专利
- CHO细胞高效表达高温紧密三螺旋重组人胶原蛋白的技术突破
3.3 公司整体发展
按照近期5年的发展情况,下表是来自财报的业绩表
| 年份 | 营业收入(亿元) | 归母净利润(亿元) | 同比增长(收入/净利润) |
|---|---|---|---|
| 2019 | 9.57 | 5.75 | — / — |
| 2020 | 11.90 | 8.26 | +24.4% / +43.7% |
| 2021 | 15.52 | 8.28 | +30.4% / +0.2% |
| 2022 | 23.64 | 10.02 | +52.3% / +21.0% |
| 2023 | 35.24 | 14.52 | +49.0% / +44.9% |
| 2024 | 55.39 | 20.62 | +57.2% / +42.1% |
业务结构
- 功效性护肤品收入43.02亿元,占比77/7%
- 医用敷料收入12.18亿元,占比降至22.0%
- 保健食品及其他收入0.18亿元
品牌分类
- 可复美收入45.42亿元,占比高达82%
- 可丽金营收8.41亿元,占比15.2%
渠道方面,线上直销占比从65.2%升到71.6%
超过140个SKU
科技是第一生产力,不仅体现在AI上,也体现在生物上。中国企业通过合成生物学实现”成本革命”。
- 锦波生物利用大肠杆菌体系生产重组III型胶原蛋白,突破164.88度三螺旋结构技术,成本下降到2000元/g。
- 巨子生物开发217Da Mini肽,透皮吸收率显著提升
- 创健医疗宣布研发出了氨基酸序列与人天然胶原蛋白完全一致且具有天然三螺旋结构的III型重组人胶原蛋白,并能够实现产业化。
高活性+高稳定性依然是现在的瓶颈,当前生物活性仅为60-70%